三、B细胞的发育
鸟类的法氏囊是B细胞分化的场所。哺乳类动物在胚胎早期,B细胞分化的最早部位是卵黄囊,此后在脾和骨髓,出生后则在骨髓内分化成熟。
B细胞分化过程可分为二个阶段,即抗原非依赖期和抗原依赖期。在抗原非依赖期,B细胞分化与抗原刺激无关,主要在中枢免疫器官内进行。而抗原依赖期是指成熟B细胞受抗原刺激后,可继续分化为合成和分泌抗体的浆细胞阶段,主要在周围免疫器官内进行。
(一)骨髓微环境
早期B细胞的增殖与分化,其发生是与骨髓造血微环境(hemopoietic inductive microenviroment,HIM)密切相关。HIM是由造血细胞以外的基质细胞(stroma cell)及其分泌的细胞因子和细胞外基质(extracellular matrix,ECM)组成。基质细胞可包括巨噬细胞、血管内皮细胞、纤维母细胞、前脂肪细胞、脂肪细胞等。由间质细胞分泌的纤粘连蛋白、胶原蛋白及层粘连蛋白等形成细胞外基质,此外还可合成和分泌众多的细胞因子。HIM的作用主要是通过细胞因子可调节造血细胞的增殖与分化,通过粘附分子可使造血细胞与间质细胞相互直接接触,有利于造血细胞的定位和成熟细胞的迁出(表8-12,图8-5)。
表8-12 骨髓微环境与造血干细胞的相互作用
| 基质细胞 | 相互作用的媒介分子 细胞外基质 | 细胞因子 |
| 纤维母细胞 | 纤粘连蛋白 | SCF |
| 巨噬细胞 | 层粘连蛋白 | G-CSF |
| 内皮细胞 | 胶原蛋白等 | M-CSF |
| 前脂肪细胞 | GM-CSF | |
| 脂肪细胞 | IL-4 | |
| IL-6 | ||
| IL-7 | ||
| TGF-β |

图8-5 骨髓基质细胞与造血干细胞相互作用示意图
(二)B细胞在骨髓内的发育
B细胞与其它血细胞一样,也是由骨髓内多能干细胞分化而来。过去曾认为T和B细胞可能来自共同的淋巴样干细胞,但迄今对基分化途径、分化部位以及其特异的表面标志尚未明确,有待进一步研究。
已证明,B细胞在骨髓内的发育,可经过祖B细胞(pro-B)、前B细胞(pre-B)、不成熟B细胞(immatureB)及成熟B细胞(mature)几个阶段。成熟B细胞释放至周围淋巴组织,构成B细胞库,在此阶段经抗原刺激后,可继续分化为合成和分汔抗体的浆细胞,即抗原依赖的分化阶段。
B细胞在骨髓内分化各阶段的主要变化为免疫球蛋白基因的重排和膜表面标志的表达。B细胞在发育分化过程中,同样也经历选择作用,以除去非功能性基因重排B细胞和自身反应性B细胞,形成周围成熟的B细胞库(表8-13,图8-13)。
表8-13 B细胞分化特征
| Pro-B | Pre-B | 不成熟B | 成熟B | PC | |
| 抗原依赖 | - | - | + | + | - |
| 基质细胞依赖(配体?) | + | + | - | - | - |
| H链V基质重排 | - | DJ→VDJ | VDJ | VDJ | - |
| H链蛋白 | μ- | μ+ | μ+ | μ+δ+ | + |
| L链蛋白 | k-λ- | k-λ- | K+或λ+ | K+或λ+ | + |
| Vpre-B/γ5蛋白 | + | + | ± | + | - |
| SIgM | - | - | + | + | - |
| SIgD | - | - | - | + | - |
| thy-1 | + | - | - | - | - |
| B220 | + | + | + | + | - |
| Tdt | + | - | - | - | - |
| mb-1(CD79a) | + | + | + | + | - |
| B29(CD79b) | - | + | + | + | - |
| CD19 | + | + | + | + | - |
| CD21 | - | + | + | + | - |
| PCA-1 | - | - | - | - | + |
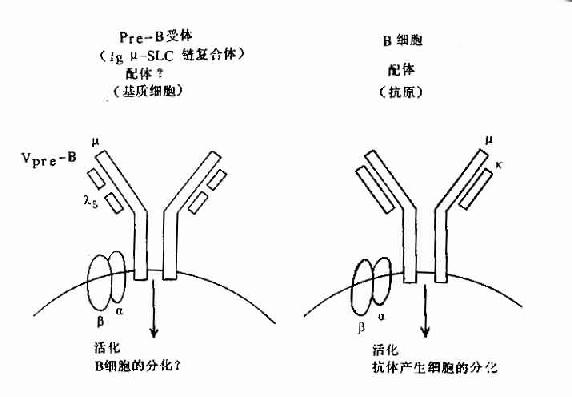
图8-6 pre-B受体(μ-SLC)与B细胞抗原受体机能
1.祖B细胞 这种发育早期的B细胞,发生在人胚胎约第9周开始,小鼠约第14天开始。尚未表达B细胞系的特异表面标志,也未发生lg基因重排,仍处于胚系基因(germline)阶段。但祖B细胞的晚期可出现B系特异标志,Thy-1+、Tdt+、B200+、mb-1+等分子。
2.前B细胞 是由祖B细胞分化而来,约占成人骨髓有核细胞的5%。前B细胞能检出的最早标志是lg重链基因重排,随后在胞浆中可检测出IgM的重链分子,即μ链。但无轻链基因重排,因此也无膜Ig表达。
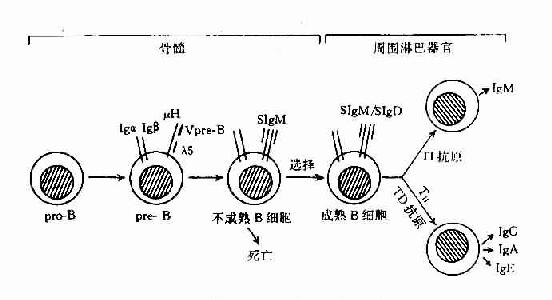
图8-7 B细胞分化膜式图
但近年在小鼠前B细胞株中,克隆出二个前B细胞特有的基因,并与Cγ与Vγ同源,分别命名为λ5和Vpre-B基因,在人也证明前B细胞中存在此种基因。它们编码的蛋白Vpre-B和λ5可非共价结合,形成伪轻链(pseudo L chain,Фl)或替代轻链(surrogate L chain)。此伪L链可与μ链结合形成μ重链与伪L链复合体,并表达于前B细胞膜上构成其受体,与信号传导有关,对前B细胞的进一步分化具有重要作用。
此阶段还表达MHCⅡ、Tdt、CD19、CD10、CD20和CD24等分化抗原。其中CD19、CD20、和CD22在胞浆中的出现均早于μ链。前B细胞对抗原无应答能力,不表现免疫功能。
3.不成熟B细胞 此阶段发生L链基因重排,故可组成完整的IgM分子,并表达于膜表面(IgM),可称为Bμ细胞。此种细胞如与抗原结合,易使膜受体交联,产生负信号,使B细胞处于受抑状态,不能继续分化为成熟B细胞。这种作用可能是使自身反应B细胞克隆发生流产,是形成B细胞自身耐受的机制之一。
不成熟B细胞开始丧失Tdt和CD10,但可表达CD22、CD21及FcR。同时CD19、CD20以及MHCⅡ类分子表达量增加。
4.成熟B细胞 随着B细胞的进一步分化,可发育为成熟B细胞,并离开骨髓进入周围免疫器官。此时膜表面可同时表达sIgM和sIgD,但其V区相同,而C区不同,故其识别抗原特异性是相同的。成熟B细胞可发生于一系列膜分子变化,可表达其它多种膜标志分子,如丝裂原受体、补体受体、Fc受体、细胞因子受体,病毒受体以及一些其它分化抗原等。
5.浆细胞(PC) 成熟B细胞可在周围淋巴器巴接受抗原刺激,在TH细胞及抗原呈递细胞的协助下,及其产生的细胞因子作用下可使B细胞活化,增殖并分化为合成和分泌抗体的浆细胞。此阶段B细胞可逐渐丢失一些膜分子如CD19和CD22等。并可发生Ig的类别转换,从产生IgM转换为产生Igg 、IgA或IgE的B细胞。
在此期分化过程中,有部分B细胞可恢复为小淋巴细胞,并停止增殖和分化,SIgD可消失,且寿命长,可生存数月至数年。当再次与同抗原相接触时易于活化和分化,故称此种细胞记忆B细胞,与机体的再次免疫应答相关。
当成熟B细胞分化为浆细胞时,B细胞表面的部分标志消失,并出现一些新的浆细胞特有标志,如浆细胞抗原-1(PCA-1)等分子。一种浆细胞只能产生一种类别的Ig分子,并且丧失产生其它类别的能力。浆细胞寿命长较短,其生存期仅数日,随后即死亡。

- B细胞的发育《医学免疫学》
- B细胞表面标志的检测《免疫学和免疫学检验》
- B细胞的分化《细胞和分子免疫学》
- B细胞被多克隆激活《医学免疫学》
- B细胞的膜表面分子《细胞和分子免疫学》
- B细胞《医学免疫学》
- B细胞功能的检测《免疫学和免疫学检验》
- B细胞《医学免疫学》
- B细胞膜主要表面分子《医学免疫学》
- B细胞《细胞和分子免疫学》
- B细胞缺陷性疾病《医学免疫学》
- B细胞《免疫学和免疫学检验》
- B细胞数目及功能的检测《医学免疫学》
- B淋巴细胞和免疫球蛋白的表达《实用免疫细胞与核酸》
- B细胞亚类《医学免疫学》
- B淋巴细胞的分化和表面标志《细胞和分子免疫学》
- B因子《细胞和分子免疫学》
- B淋巴细胞《实用免疫细胞与核酸》
- C《金匮悬解》
- Brown- Sequard氏综合征《神经精神疾病诊断学》
- C《四圣心源》
- Bristowe氏综合征《神经精神疾病诊断学》
- C《四圣悬枢》
- Bogorad氏综合征《神经精神疾病诊断学》
- C《生理学》
- BLS-CPR时的第一线药《急诊医学》
- C《医学统计学》
- Bianchi氏综合征《神经精神疾病诊断学》
- C《医学遗传学基础》
- BEST疾病《基因与疾病》
- C《传染病》
《医学免疫学》
- 第一篇 免疫系统的组织结构
- 第一章 绪论--免疫学发展简史
- 第一节 免疫学的经验时期
- 第二节 经典免疫学时期
- 第三节 近代免疫学时期
- 第四节 现代免疫学时期
- 第五节 免疫学在生物学和医学发展中的作用
- 第二章 免疫球蛋白分子
- 第一节 抗体的发现及其特性
- 第二节 免疫球蛋白分子的结构与功能
- 第三节 各类免疫球蛋白的生物学活性
- 第四节 免疫球蛋白基因的结构和抗体多样性
- 第五节 抗体的制备
- 第三章 补体系统
- 第一节 补体系统的组成和理化性质
- 第二节 补体系统的激活
- 第三节 补体受体及其免疫学功能
- 第四节 补体的生物学活性
- 第五节 血清补体水平与疾病
- 第四章 细胞因子
- 第一节 细胞因子的概述
- 第二节 细胞因子及其受体的结构
- 第三节 细胞因子的生物学活性
- 第四节 细胞因子的临床意义
- 第五章 免疫细胞膜分子(一):主要组织兼容性抗原
- 第一节 MHC基因结构
- 第二节 MHC抗原
- 第三节 MHC分子的功能
- 第四节 HLA的医学意义
- 第五节 HLA分型技术
- 第六章 免疫细胞膜分子(二):白细胞分化抗原
- 第七章 免疫细胞(一):造血干细胞
- 第一节 造血干细胞的特性
- 第二节 造血干细胞的分化
- 第三节 造血干细胞与淋巴细胞的发生
- 第八章 免疫细胞(二):淋巴细胞系
- 第一节 T细胞
- 第二节 B细胞
- 第三节 第三群淋巴细胞
- 第九章 免疫细胞(三):单核吞噬细胞系统
- 第一节 单核吞噬细胞系统
- 第二节 其他抗原呈递细胞
- 第三节 抗原呈递细胞的抗原呈递作用
- 第二篇 免疫系统的生理功能
- 第十章 抗原
- 第一节 抗原的概念和特性
- 第二节 抗原的免疫原性
- 第三节 抗原的抗原性
- 第四节 抗原的分类
- 第十一章 免疫应答(一):B细胞介导的体液免疫
- 第一节 免疫应答的概念与过程
- 第二节 抗体产生的细胞学基础
- 第三节 抗体形成过程中免疫细胞间的相互作用
- 第四节 免疫记忆
- 第五节 体液免疫的效应
- 第六节 体液免疫应答的调节
- 第十二章 免疫应答(二):T细胞介导的细胞免疫
- 第十三章 免疫应答(三):免疫耐受
- 第一节 免疫耐受现象的发现
- 第二节 影响免疫耐受形成的因素
- 第三节 免疫耐受的维持和终止
- 第四节 免疫耐受的机制
- 第五节 免疫耐受的临床意义
- 第十四章 免疫应答(四):免疫调节
- 第一节 免疫系统的调节
- 第二节 遗传对免疫应答的调节
- 第三节 神经内分泌免疫网络调节
- 第三篇 免疫病理
- 第十五章 超敏反应
- 第一节 Ⅰ型超敏反应
- 第二节 Ⅱ型超敏反应
- 第三节 Ⅲ型超敏反应
- 第四节 Ⅳ型超敏反应
- 第十六章 自身免疫和自身免疫病
- 第一节 生理性自身免疫现象
- 第二节 病理性自身免疫应答的诱因
- 第三节 病理性自身免疫发生机制
- 第四节 自身免疫性疾病
- 第五节 自身免疫病治疗原则
- 第十七章 免疫缺陷
- 第一节 免疫缺陷病的分类
- 第二节 免疫缺陷病的一般特征
- 第三节 常见的原发性免疫缺陷病
- 第四节 继发性免疫缺陷病
- 第十八章 肿瘤免疫
- 第十九章 移植免疫
- 第一节 器官移植排斥的类型
- 第二节 移植反排斥的机制
- 第三节 移植排斥的防止
- 第二十章 免疫学检测法
- 第一节 抗原或抗体的检测
- 第二节 体液免疫功能的检测
- 第三节 细胞免疫功能的检测
- 第四节 分子生物学技术在免疫学诊断中的应用
- 第二十一章 免疫治疗学
- 第一节 免疫增强药物及免疫增强疗法
- 第二节 免疫抑制剂及免疫抑制疗法
- 第三节 生物应答调节与免疫治疗
- 主要参考资料










