四、可进行微循环观察的动物器官及方法
(一)头部器官
动物的眼球结膜、虹膜、眼底、鼻粘膜、口唇、牙龈、舌、鼓膜、耳壳等都可以普通显微镜在放大40倍到100倍的条件下进行微循环观察。这些部位的动物观察方法与人的相似。以家兔眼球结膜观察方法为例:要选用白色家兔,因其球结膜色白,微血管精晰可见。不可采用灰色或黑色的家兔,因其球结膜色深,不易辨别其微血管。将2~2.5kg体重的白毛家兔的在清醒状态下侧卧位置于一特制的长方形固定盒内,使两耳及其头部露出,头颈部和嘴用兔头夹和铁环加以固定,剪去左侧眼睑睫毛,以眼科开睑器将上下眼睑撑开,暴露出球结膜血管,然后用高压水银聚光灯,以45度斜照于球结膜上,双目解剖显微镜放大40倍,可直接观察到球结膜的微循环。
(二)气管微循环观察法
选用大白鼠或家兔麻醉后,剪去下颌及颈部的毛,消毒皮肤,固定四肢(仰卧)。沿颈正中线自下颌部甚胸骨上缘作垂直切口,剥离软组织与肌肉,小心不要损伤血管,用两把纹式止血钳夹住两胸锁乳突肌中部轻轻拉开。于甲状软骨环上轻轻剪断一对胸骨甲状肌及其附着的肌膜,将该肌肉放于远端,便可暴露自甲状软骨至第十软骨环间区的气管,轻轻于解剖镜下(放大16倍)剔去气管表面的结缔组织,便可以将光射于放大60倍左右的气管软骨上以及软骨环间区的粘膜上观察微循环的动态变化。观察应于恒温装置中进行,并在气管表面滴以恒温灌流液。
正常大鼠或家兔气管软骨环间区的微血管较为丰富。细静脉、细动脉血流方向相反,毛细血管网穿插于细动脉和细静脉间,而在软骨环表面上有极细的毛细管网。微血管内血流均匀,流速较快,血管充盈度良好。连续观察25~30分钟不见有明显改变。气管炎模型的大鼠气管微循环出现明显变化,变化程度与气管粘膜病变程度密相关。活血化瘀药物注入后,可明显改善大鼠气管炎微循环障碍。
(三)肺微循环观察方法
一般用家兔、猫、狗或其它大动物进行。动物麻醉后呈右侧卧位固定于动物台上,净皮、去左胸部的毛,消毒皮肤。于第三、四肋间作弧形切口,剥离皮肤,沿胸骨边缘轻轻剪断胸大肌、胸小肌的附着处,将二肌肉剥向一边。在三、四肋间沿肋骨边缘用钝头眼科剪和眼科镊轻轻剔去肋间肌。注意要特别小心,谨防损伤胸膜。只要在胸膜上造成针尖大小的孔,肺便可发生萎陷。因此,肋间肌要一束一束仔细地剔去。最后可暴露无遗1cm见方的窗,透过透明的胸膜于显微镜下观察肺循环动态。此即“胸膜开窗”法。
开窗部位最好在第三、四肋间或第五、六肋间靠中线的地方。此外较薄的肺叶以心包作衬底,易于观察。由于观察的是呼吸着的肺,所以观察者要善于抓住动物的呼吸规律,选其呼吸空间进行观察,也可进行照明。
“胸膜开窗”是观察活体肺微循环的唯一可行的办法,因为肺脏一暴露于空气下便萎缩。如能将染料注入法、同位素注入或荧光示踪及肺血流量测定法与胸膜开窗活体观察法配合进行,便可得到更理想的结果。“胸膜开窗”观察肺微循环是可以连续进行的;第一次观察完毕后,可用一圆形有机玻璃薄片敷于窗上,以缝线固定于周围肌肉,将胸小肌、胸大肌恢复原位,缝合皮肤切口,加强护理。可于第2天、第3天、第4天连续重复上述步骤,进行反复观察。一般在第4、5天,胸膜上便生出一层结缔组织,变为不透明。此时如有必要可选其它肋间进行再次开窗,手术应在消毒条件下进行。
(四)背斜方肌微循环观察法
大鼠背斜方肌很薄,表浅,易于照明,面积宽而长,血管神经可保持完整。制备方便而简单,10~15分钟可完成全部制备。此外皮肤切口可丝毫不损伤周围组织,而且不易造成出血。对动物整个机体影响不太大,可进行长时间观察,而且这个部位易于进行显微镜下观察。因此,背斜方肌对于研究血管活性物质和机体对药物的应答反应是非常方便和理想的。
背斜方肌又称脊肩胛肌,是成对的肌肉,它纵伸于背部到腰部,它的肌纤维自第4胸椎至第3腰,并向两边伸展至肩胛线,它的神经支配来自脊副神经和第2、3颈部神经。它的供血来自腋动脉的肩胛下支和颈表浅动脉有肌肉分支。它的静脉注入前颈静脉。
实验采用大白鼠或金黄地鼠,体重70~120g,高于120g体重的鼠其背斜方肌过大过厚,不利于照明。用30mg/100g剂量戊巴比妥钠麻醉。将动物背部去毛、消毒。自颈部至腰部沿脊柱中线作皮肤切口。剥离结缔组织,用小虹膜剪将肌肉筋膜轻轻剥离,在肌肉侧面作一小小切口并用小弯剪轻轻剥开肌肉游离面(沿肩胛线),将小剪伸向肌肉底部将其完全与底层肌肉剥离。如遇有一两支小血管可以用4号将线结扎。这样便可得到一个宽为1.5cm左右的游离肌肉瓣。观察时使动物侧卧,将肌肉游离边用细大头针固定于特制灌流盒上(与金黄地鼠灌流盒类似)。用含有1%明胶的林格氏液灌流。用NaHCO3将pH调为7.35,灌流液保持35~37℃。
利用脊斜方肌制备可进行低倍、高倍、水镜、油镜观察。可以进行极漂亮的电影拍摄,可以清晰地分辩粘附于管壁的白血球。可以进行各种药物作用的研究,尤其适于微电极插入或微传感器插管进行在体微血管压力和微血流测定。
(五)颊囊微循环观察法
实验选用叙利亚种金黄地鼠,雄性,体重90~120g,在动物口腔两侧后角各有一颊囊供贮存食物之用。颊囊组织与皮肤组织相似。是由纤维结缔组织、鳞状上皮、骨骼肌、疏松结缔组织四层构成。颊囊的伸缩性很大,其容量可由1~2ml扩张到5~6ml。颊囊血供丰富,有致密的微血管网,是各种口径的微血管高度集中之地。颊囊组织薄而嫩,颜色淡,透光性好,微血管清晰,制备简单,既可作急性实验,也可作慢性连续观察实验,而且由于它是双侧对称器官,有些实验过程可在同一动物身上进行自身照射。
1.颊囊的简单制备 实验时,动物腹腔注以2.5%戊巴比妥钠30mg/kg体重进行麻醉。然后将口腔打开,沿一侧颊边轻轻伸进中号钝头镊子,伸到肩部时夹住颊囊盲端,从口中取出内面翻于外的盲囊,以滴管用37℃左右的生理盐水冲净其上的食物残渣,将颊囊展平,用弯形大头针固定于以透明有机玻璃制作的颊囊灌流盒上。启动恒温灌流系统并将灌流盒置于显微镜下,即可以透射光观察颊囊上微血管各项指标(放大100倍以下)。如观察需放在100倍以上进行,则需制备单层颊囊。此时颊囊上选择一个毛细血管网最少的区域,剪一个小切口。如需大面积观察则可沿颊囊动脉平行部分作纵长切品,在切口边缘部尚可作小小横切(垂直向两边)。其后用小虹膜剪在解剖镜下将疏松结缔组织移去。经过这样制备的颊囊,在显微镜下成象更加清晰。
2.颊囊的恒温灌流 颊囊灌流盒底板形态如图10-11所示,是一个24×18cm2的透明有机玻璃板,板上固定以直径为6cm、高为0.8cm的圆槽,槽中套以直径为4cm、高为0.4cm的开口双层环槽。环槽中灌以弹性透明硅橡胶,由圆槽一边底部输入恒温灌流液,另一端输出灌流液。灌流液的pH应调为中性(pH=7.35)并通过氧气。灌流液的温度以控温仪或以恒温水浴控制在37℃。整个实验过程中,恒温灌流液以慢速徐徐通过颊囊表面及底面。
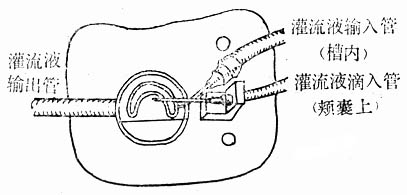
图10-11 金黄 地鼠颊市灌流装置
3.颊囊小室制备法
颊囊小室由底板和顶板组成,两板面积相同(直径为2~2.5cm)。顶板边缘有凹槽,中央有圆窗,圆窗粘以极薄的透明有机玻璃或云母片。底板由较薄的透明有机玻璃作成。两板在相应部位各有两个小孔。底板两孔处固定两个有机玻璃的小楔子,可穿进顶板上的两孔。
动物麻醉后,刮去一侧颊部、颈部及肩部的毛。先将颊囊从口内取出,以生理盐水冲洗净并放回。之后将小室底板用镊子轻轻塞入左侧颊囊,尽可能送到颊囊盲端。使动物右侧卧、固定。消毒皮肤,透过皮肤可触到入在颊囊中的底板的两楔,用消毒手术器械在两楔间皮肤作一小切口,并小心扩展切口到底板直径长。剥离结缔组织,使覆盖有颊囊膜的底板完全暴露于解剖镜下,用虹膜剪将膜上疏松结缔组织清除。注射不能损伤血管。为防止组织过干或发生血瘀,上述步骤要尽速进行。
上述步骤完毕后,于底板颊囊上滴以生理盐水,将1mm2的肿瘤组织块轻轻入于颊囊膜中央,迅速将顶板的两孔穿进底板两楔、盖紧(防止气泡进入),然后于每一楔孔滴以有机粘合剂,此时,于两板间形成一个小室,在此小室中肿瘤组织可生长。将皮肤切口边缘先以普通缝线穿一圈,再紧紧扎入顶板侧槽。于小室周围敷以胺黄粉。小室制备即完成。为防止感染,给动物每日肌内注射2500单位的多粘菌素B,3~4天。
利用颊囊小室法可进行多种恶性肿瘤移植的研究,如乳腺癌、黑色素瘤、血管周期细胞瘤、神经鞘瘤等,并可于瘤组织植入后任何时间透过小室以显微镜观察瘤组织周围血管再生及发育情况和特点。
(六)缝匠肌微循环观察法
实验选用猫。猫的缝匠肌是一种可以用于进行离体实验或在体透明实验的最好的肌肉。可以用以进行正常微血流、微血压、充血、出血以及胃骼肌微血流调节的研究。
缝匠肌是大腿内侧表浅肌肉,它起于髂前上棘,终于胫骨近端和髌骨。其内缘之下正是股动脉和股静脉,有9cm长,4cm宽,由它可取得平均5g重的离体肌肉。
缝匠肌的供血由侧旋股动脉及股动脉分支而来,其远端尚有下行膝动脉供血。
实验时,动物以75mg/kg体重剂量的α-氯醛醣静脉注射麻醉。动物侧卧位固定,将其一腿(下部的)伸展。净皮,去毛并消毒,沿大隐静脉走向自腹股沟下1cm处至膝内侧作皮肤切口,轻轻剥离皮肤。其后,于大腿内缘与该切口相平行作另一切口。尽可能将皮肤剥离以暴露更大面积的肌内。露暴软组织以恒温灌流液浸透的纱布湿敷。在将缝匠肌中间部位的筋膜、结缔组织剥离完全后,便可以用冷光束照明装置伸于缝匠肌正中底部,并于显微镜下观察该肌肉上的微血流和进行各种测定。
如要取得离体缝匠肌,需在上述步骤之后先将缝匠肌周围小血管一一结扎,只留下由大隐静脉和股动脉、股静脉而来的主要分支。此后,进行股动脉分支与股静脉分支插管(一支输入,一支输出)待插管圆满完成后将其它所有血管结扎(包括大隐静脉来的所有血管)。然后将肌肉两端以特制的小夹子夹住。从夹子外缘剪下,离体的肌肉挂在一个铝制支架上置于恒温,恒温装置可于显微镜下进行各种灌流实验。一块6g重的肌肉,其血液灌流量通常0.2~0.3ml/分。好的肌肉制备可连续维持6小时以上的实验。
(七)肠系膜、大网膜、肠壁微循环观察法
远在200年前就有人将肠系统、大网膜的微循环进行了显微镜观察。因为它最易取出,并且血管清晰。小鼠、大鼠、豚鼠、田鼠、家兔、猫、狗等动物的肠系膜和大网膜及肠壁皆可用于微循环观察,并且无明显差别,所用动物不宜过老,否则脂肪过多影响观察。Zweifach认为:回盲部肠系膜是最好的微循环观察区。因为它具有区域小而局限、没有肠蠕动、取出时不易损伤、脂肪组织少等优点。
实验时,动物麻醉同前。消毒腹部一侧皮肤,剪一个1~2寸的切口。动物侧卧于灌流盒边。取出欲观察的肠系膜或大网膜部位,轻轻伸展于透明有机玻璃制成的灌流盒上进行恒温灌流;灌流时流与滴相结合,灌流液用磷酸缓冲液调至pH7.2~7.35。灌流液中亦可加入白蛋白,使其成为1%白蛋白液。灌流液原瓶中通以O2和5%CO2。
在进行肠系膜微循环观察时,要特别注意维持动物体温恒定。因为过冷或过热都要引起不正常的肠蠕动,影响实验效果。为此,必须监测动物肛温或口温。连续记录体温曲线。动物最好躺在电热垫上并盖以小被维持恒定的正常体温。一般说来,一切条件保持得好,可连续进行两小时以上的正常实验,也可能5~6小时都保持平衡,应该停止实验的早期信号是:肠系膜上收集静脉中出现白细胞附壁粘着现象;其后是红血球渗出。因之,如不维持严格的恒温灌流和保持恒定的体温,所进行肠系膜的微循环动态记录肯定是不客观的。
家兔肠系膜微循环观察时,以乌拉坦或戊巴妥纳静脉注射麻醉后,背住缚于兔板上(有加温装置),剪去腹部之毛,沿腹中线作一长6~8cm的切口进入腹腔。将上腹腔脏器推向右侧,于腹腔左上方找到回盲交界处(回肠为浅红色,结肠为灰色)在该部位上的上段轻轻拉回肠袢约10cm,将该段肠管及系膜通过有机玻璃流盒的后侧壁凹槽和裤形装(见图10-12),然后浸入充满38℃灌流液的小盒中,并轻轻把肠系膜平铺在灌流盒的中央圆合上,用大头针将肠系膜固定于中央圆台内侧边的软木片上。将腹壁、浆膜层和肌层缝合,并把切口右缘皮肤缝合固定于灌流盒侧壁的锁眼处。
图10-12 检查家兔肠系膜微循环灌流盒
灌流盒右侧壁有一进水管与盛满任一台氏营养液的恒温压灌流瓶相连接,使营养液不断地流经小盒而自左侧壁的出水管口流出。以80W高压水银灯的光束投照平铺在中央圆台上的腹系膜上,双目显微镜放大40~80倍,可进行肠系膜血管口径、血流速度和血流状态观察。为了防止造成肠系膜的局部血流障碍和游斑性出血,要避免过分牵拉或摩擦肠系膜,要不断向肠系膜上滴加温热的生理盐水,避免干燥刺激。
(八)提睾丸微循环观察法
实验采用雄性大白鼠,体重80~110g,小于80g的大鼠提睾肌太小不利于制备,大于110g的大鼠太老,结缔组织增生,不利于观察。以25mg/kg体重剂量的戊巴比妥纳麻醉大鼠,或以130mg/100体重剂重的乌拉坦肌注(经常注入股田头肌)。将手术区域剃毛、洗净、消毒,最好进行气管切开,插管以保证呼吸顺利。进行股动脉插管测动脉压或准备静注药物。手术器械进行消毒。手术时,先用针在手术侧阴囊远端穿以缝线,将缝线固定在动物固定板的小钉上。然后在阴囊上作纵切口,切开皮肤、筋膜,轻轻剥离。将切口慢慢延长到离腹沟5~8mm处。用胶体林格氏液(pH7.35)开始轻轻灌流,于剥离的软组织上敷一层灌脱脂棉絮,棉絮浸以灌流液。将皮肤切口之每边穿两根丝线固定于动物板上。如图10-12所示,继续游离提睾肌,使之脱脑周围组织。将提睾肌轻轻作纵向切开并将其轻轻与睾丸剥离。用两个外科结扎连接睾丸和提睾肌的小血管,从两结中间剪断。如图10-13所示沿副睾纵柚将附睾系膜剪开。将睾丸和附睾经腹股沟环轻轻送入腹腔。提睾肌周围等距穿进5~6根丝线。动物仰卧,将提睾肌展铺于特制的马蹄形透明有机玻璃柱上,柱周围有等距的5~6个小钵,可将丝线结于钉上固定提睾肌。透明柱可调高低,其周围为恒温灌流盒(与金黄地鼠颊囊灌流装置相似)。
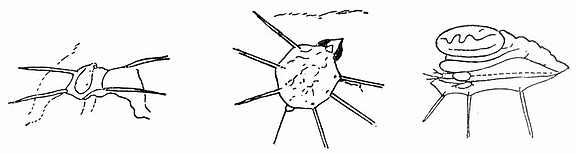
图10-13 分离提睾肌方法
提睾肌极薄,其上有各种口径的微血管,成像清晰,适于进行各种微循环参数测定,尤其独特的是提睾肌上最微细的毛细血管网也特别清楚,适于进行管腔、管壁动态变化和微血管与组织间物质交换的研究。也可用染料或荧光示踪剂进行淋巴微循环的研究。

- 可进行微循环观察的动物器官及方法《实验动物科学》
- 可见光疗法《理疗学》
- 可久针肉龟《古今医统大全》
- 可火不可火证《伤寒总病论》
- 可灸不可灸歌《伤寒百证歌》
- 可火不可火歌《伤寒百证歌》
- 可灸不可灸证《伤寒总病论》
- 可行性试验《预防医学》
- 可聚实《千金翼方》
- 可汗一《伤寒悬解》
- 可聚实《新修本草》
- 可汗不可汗歌《伤寒百证歌》
- 可聚实《证类本草》
- 可汗《伤寒括要》
- 可聚实《名医别录》
- 可发汗证《伤寒总病论》
- 可卡因滥用《默克家庭诊疗手册》
- 可发汗五十八条《仲景伤寒补亡论》
- 可卡因类药物中毒《医院药学》
- 可待因(Codeine甲基吗啡)《医院药学》
- 可乐定《药理学》
- 可待因《药理学》
- 可能影响肝炎病情的某些因素《传染病》
- 可待因《药理学》
- 可溶性抗原的制备和纯化《免疫学和免疫学检验》
- 可保立苏汤《医林改错》
- 可溶性细胞因子受体《细胞和分子免疫学》
- 咳证《类经》
- 可溶性粘附分子《细胞和分子免疫学》
- 咳血门《幼科切要》
- 可水不可水歌《伤寒百证歌》
《实验动物科学》
- 第一章 实验动物科学绪论
- 第一节 研究范围和发展意义
- 第一节 国内外实验动物科学发展情况
- 第二节 实验动物科学在生物医学发展中的作用
- 第三节 动物的类群和生物学分类上的位置
- 第四节 实验动物的分类方法
- 第二章 常用实验动物的特点及应用
- 第一节 小鼠(Mouse;Musculus)
- 第二节 大鼠(Rat;Rattus norregicus)
- 第三节 豚鼠(Guine-pig;Cavia porcellus)
- 第四节 地鼠(Hamster)
- 第五节 家兔(Rabbit,Oryctolagus curiculus)
- 第六节 狗(Dog;Canis familiaris)
- 第七节 猴(Monkeys)
- 第八节 猫(Cat;Felis Catus)
- 第九节 猪(Swine;Sus scrofa)和小型猪
- 第十节 其他实验动物
- 第三章 近交系动物的特点及应用
- 第一节 近交和近交系
- 第二节 近交系的特征和应用意义
- 第三节 近交系的培育技术
- 第四节 近交品系的命名法
- 第五节 近交系的新进展
- 第六节 常用近交系动物品系特征
- 第四章 突变系动物的特点及应用
- 第一节 突变系动物的基本概念
- 第二节 突变品系的模型性状
- 第三节 带病理模型性状的突变株
- 第四节 突变基因的特点
- 第五节 无胸腺裸鼠特点及应用
- 第五章 杂交群和封闭群动物的特点及应用
- 第一节 杂交群动物(F1)的特点及应用
- 第二节 封闭群动物的特点及应用
- 第六章 无菌动物、悉生动物和无特定病原体动物的特点及应用
- 第一节 无菌动物
- 一、无菌动物的基本概念
- 二、无菌动物的发展
- 三、无菌动物的特征
- 四、无菌动物技术
- 五、无菌动物的饲料和饲育装置
- 六、无菌动物的检查
- 七、无菌动物在生物医学研究中的应用
- 第二节 悉生动物
- 第三节 无特定病原体动物
- 第七章 野生动物在生物医学研究中的应用
- 第一节 开发野生动物的意义
- 第二节 黑线仓鼠
- 第三节 长爪沙鼠
- 第四节 树鼩
- 第五节 鼠兔
- 第六节 棉鼠
- 第七节 九带犰狳
- 第八节 黑线姬鼠、大仓鼠
- 第九节 有开发价值的其他野生动物
- 第八章 生物医学研究中实验动物的选择
- 第一节 选择原则和方法
- 一、选用与人的机能、代谢、结构及疾病特点相似的实验动物
- 二、选用遗传背景明确,具有已知菌丛和模型性状显着且隐定的动物
- 三、选用解剖、生理特点符合实验目的的要求的动物
- 四、选择不同种系实验动物存在的某些特殊反应
- 第二节 各类实验动物选择索引
- 第九章 生物医学研究中的动物模型
- 第一节 动物模型的意义和优越性
- 第二节 动物模型的分类
- 第三节 动物模型的设计原则和注意事项
- 第四节 动物模型的复制方法
- 第十章 生物医学重点研究课题中的实验动物选择与应用
- 第一节 免疫学研究中实验动物的选择与应用
- 第二节 单克隆抗体研究中实验动物的选择与应用
- 第三节 肿瘤学研究中实验动物的选择和应用
- 第四节 放射生物学研究中实验动物的选择和应用
- 第五节 药理学研究中实验动物的选择与应用
- 一、中枢神经系统药理学研究中的选择与应用
- 二、传出神经药理学实验中的选择与应用
- 三、心血管系统药理实验中的选择与应用
- 四、消化系统药理实验中的选择与应用
- 五、呼吸系统药理实验中的选择与应用
- 六、泌尿系统药理实验中的选择与应用
- 第六节 口腔医学研究中实验动物的选择与应用
- 第七节 计划生育研究中实验动物的选择和应用
- 第八节 微循环研究中实验动物的选择和应用
- 第九节 皮肤病学研究中实验动物的选择与应用
- 第十节 病毒学研究中实验动物的选择与应用
- 第十一节 老年病研究中实验动物的选择与应用
- 第十二节 中医中药研究中实验动物的选择与应用
- 第十一章 生物医学研究的基本途径、方法和影响因素
- 第一节 生物医学研究的基本途径
- 第二节 动物实验基本方法
- 一、动物实验的常用方法
- 二、实验动物的抓取固定方法
- 三、实验动物编号标记方法
- 四、实验动物的随机分组方法
- 五、实验动物被毛的去除方法
- 六、实验动物给药途径和方法
- 七、实验动物用药量的确定及计算方法
- 八、实验动物的麻醉
- 九、实验动物采血方法
- 十、急性动物实验中常用的手术方法
- 十一、实验动物的急救措施
- 十二、实验动物的处死方法
- 第三节 影响动物实验效果的动物因素
- 第四节 影响动物实验效果的动物饲养环境和营养因素
- 第五节 影响动物实验效果的动物实验技术环节因素
- 第十二章 实验动物常用的各种生物学数据
- 第一节 一般生物学数据
- 一、实验动物染色体数目
- 二、实验动物繁殖生理数据
- 三、实验动物组织生长和细胞更新数据
- 四、哺乳动物和人的细胞更新速度
- 五、实验动物和人各类正常组织细胞分裂间期各进相的时间
- 六、哺乳动物和人全身照射的半致死量
- 七、哺乳动物平均寿命和最长寿命
- 八、哺乳动物和人的水代谢期与寿命的关系
- 九、狗与人的年龄对应
- 十、实验动物正常新陈代谢率
- 十一、哺乳动物和人产热量和水半代谢期
- 第二节 生理学数据
- 一、实验动物红细胞总数、压积、体积、大小和血红蛋白浓度
- 二、实验动物白细胞总数、分类计数及血小板数
- 三、实验动物正常骨髓象数值
- 四、实验动物血容量、心率、心输出量
- 五、实验动物全血、血浆、红细胞的容量和静脉血比容
- 六、实验动物血液温度、酸碱度、粘稠度、比重和体温数据
- 七、实验动物血细胞脆性、沉降速度和凝血时间
- 八、实验动物正常血压数值
- 九、实验动物的循环时间
- 十、实验动物心电图正常参考数值(间期)
- 十一、实验动物心电图正常参考数值(波辐电压)
- 十二、实验动物正常心率时心脏周期情况
- 十三、实验动物血液动力学指标数值
- 十四、通气量、耗气量
- 十五、实验动物呼吸器官相对形态特点及外在气体代谢
- 十六、实验动物饲料、饮水要求量和排便排尿量
- 十七、哺乳动物肾的结构与浓缩能力
- 十八、各种动物尿比重
- 第三节 生物化学数据
- 一、实验动物血液中葡萄糖、果糖含量
- 二、实验动物血液中蛋白结合糖总量及分布
- 三、实验动物血中糖代谢产物含量
- 四、实验动物血清脂蛋白及其成分
- 五、实验动物血中脂肪、脂肪酸、甘油酯、胆固醇、胆固醇酯含量
- 六表12-41实验动物血液中磷脂总量及其分类值[SB][60][/SB]
- 七、实验动物血中磷脂总量及其分类值
- 八、实验动物血中氧和二氧化碳含量、二氧化碳压力、钠、氯离子浓度、水及蛋白质含量
- 九、实验动物血浆总蛋白、白蛋白、球蛋白、纤维蛋白原含量
- 十、实验动物血浆蛋白分类值
- 十一、实验动物血中游离氨基酸含量
- 十二、实验动物血中非蛋白氮、尿素、尿酸含量
- 十三、实验动物血中蛋白质代谢产物含量
- 十四、实验动物血及器官中5-羟色胺含量
- 十五、实验动物器官和血浆中儿茶酚胺含量
- 十六、实验动物血及器官中乙酰胆碱含量
- 十七、实验动物器官中RNA和DNA含量
- 十八、实验动物血及器官中腺苷酸含量
- 十九、实验动物血中吡啶核苷酸、辅羧酶、磷酸吡哆醛、碱性磷酸酶含量
- 二十、实验动物组织与器官中细胞色素氧化酶活性
- 二十一、实验动物器官与组织中琥珀酸脱氢酶含量
- 二十二、实验动物器官与组织中乳酸脱氢酶的活性
- 二十三、实验动物血清与器官中乳酸脱氢酶同功酶的活性
- 二十四、实验动物器官中脱氢酶活性
- 二十五、实验动物血液中氧化还原酶活性
- 二十六、大白鼠器官及血中转氨酶活性
- 二十七 兔、豚鼠器官与血中转氨酶活性
- 二十八、实验动物血及器官中转换酶活性
- 二十九、实验动物血及器官中碱性和酸性磷酸酶活性
- 三十、实验动物器官及血中水解酶活性
- 三十一、实验动物血液中胆碱酯酶活性
- 三十二、实验动物器官与组织中胆碱酯酶活性
- 三十三、实验动物器官与血中醛缩酶及碳酸酐酶活性
- 三十四、实验动物血中维生素A、胡萝卜素、维生素C与D、胆碱、肌醇含量
- 三十五、实验动物血中维生素B1、B2、B6、B12及烟酸、泛酸、叶酸含量
- 三十六、实验动物血液中无机磷、有机磷、铁的含量
- 三十七、实验动物血液中钾、钠、钙、氯、镁含量
- 三十八、实验动物血液中硫、碘、铜、锌、钴、溴、氟含量
- 三十九、实验动物生化指标综合参考值
- 第四节 脏器重量、长度和其他数据
- 附1 实验动物管理条例
- 附2 医学实验动物合格证暂行条例(北京)
- 《北京医学实验动物检定暂行标准》
- 参考文献











