(三)蛋白质翻译后加工修饰
从核糖体上释放出来的多肽链,按照一级结构中氨基酸侧链的性质,自竹卷曲,形成一定的空间结构,过去一直认为,蛋白质空间结构的形成靠是其一级结构决定的,不需要另外的信息。近些年来发现许多细胞内蛋白质正确装配都需要一类称做“分了伴娘”的蛋白质帮助才能完成,这一概念的提出并未否定“氨基酸顺序决定蛋白空间结构”这一原则。而是对这一理论的补充,分子伴娘这一类蛋白质能介导其它蛋白质正确装配成有功能活性的空间结构,而它本身并不参与最终装配产物的组成。目前认为“分子伴娘”蛋白有两类,第一类是一些酶,例如蛋白质二硫键异构酶可以识别和水解非正确配对的二硫键,使它们在正确的半胱氨酸残基位置上重新形成二硫键,第二类是一些蛋白质分子,它们可以和部分折叠或没有折叠的蛋白质分子结合,稳定它们的构象,免遭其它酶的水解或都促进蛋白质折叠成正确的空间结构。总之“分子伴娘”蛋白质合成后折叠成正确空间结构中起重要作用,对于大多数蛋白质来说多肽链翻译后还要进行下列不同方式的加工修饰才具有生理功能。
1.氨基端和羧基端的修饰
在原核生物中几乎所有蛋白质都是从N-甲酰蛋氨酸开始,真核生物从蛋氨酸开始。甲酰基经酶水介而除去,蛋氨酸或者氨基端的一些氨基酸残基常由氨肽酶催化而水介除去。包括除去信号肽序列。因此,成熟的蛋白质分子N-端没有甲酰基,或没有蛋氨酸。同时,某些蛋白质分子氨基端要进行乙酰化在羧基端也要进行修饰。
2.共价修饰
许多的蛋白质可以进行不同的类型化学基团的共价修饰,修饰后可以表现为激活状态,也可以表现为失活状态。
(1)磷酸化:
磷酸化多发生在多肽链丝氨酸,苏氨酸的羟基上,偶尔也发生在酪氨酸残基上,这种磷酸化的过程受细胞内一种蛋白激酶催化,磷酸化后的蛋白质可以增加或降低它们的活性,例如:促进糖原分解的磷酸化酶,无活性的磷酸化酶b经磷酸化以后,变居有活性的磷酸化酶a。而有活性的糖原合成酶I经磷酸化以后变成无活性的糖原合成酶D,共同调节糖元的合成与分介。
(2)糖基化:
质膜蛋白质和许多分泌性蛋白质都具有糖链,这些寡糖链结合在丝氨酸或苏氨酸的羟基上,例如红细胞膜上的ABO血型决定簇。也可以与天门冬酰胺连接。这些寡糖链是在内质网或高尔基氏体中加入的(图18-20)。
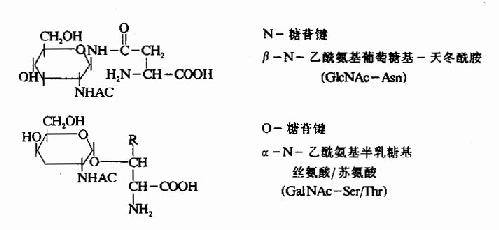
图18-20 糖蛋白中常见的糖一肽连接键
(3)羟基化:
胶原蛋白前α链上的脯氨酸和赖氨酸残基在内质网中受羟化酶、分子氧和维生素C作用产生羟脯氨酸和羟赖氨酸,如果此过程受障碍胶原纤维不能进行交联,极大地降低了它的张力强度。
(4)二硫键的形成:
mRNA上没有胱氨酸的密码子,多肽链中的二硫键,是在肽链合成后,通过二个半胱氨酸的疏基氧化而形成的,二硫键的形成对于许多酶和蛋白质的活性是必需的。
3.亚基的聚合:
有许多蛋白质是由二个以上亚基构成的,这就需这些多肽链通过非共价键聚合成多聚体才能表现生物活性。例如成人血红蛋白由两条α链,两条β链及四分子血红素所组成,大致过程如下:α链在多聚核糖体合成后自行释下,并与尚未从多聚核糖体上释下的β链相连,然后一并从多聚核糖体上脱下来,变成α、β二聚体。此二聚体再与线粒体内生成的两个血红素结合,最后形成一个由四条肽链和四个血红素构成的有功能的血红蛋白分子。
4.水介断链:
一般真核细胞中一个基因对应一个mRNA,一个mRNA对应一条多肽链,但也有少数的情况,即一种三思而行翻译后的多肽链经水介后产生几种不同的蛋白质或多肽。例如哺乳动物的鸦片样促黑皮激素原初翻译产物为265个氨基酸,它在脑下垂体前叶细胞中,POMC初切割成为N-端片断和C端片段的β-促脂解激素。然后N端片段又被切割成较小的N端片断和工9肽的促肾上腺皮质激素。而在脑下垂体中叶细胞中,β-促脂解激素再次被切割产生β-内啡肽;ACTH也被切割产生13肽的促黑激素(α-melanotropin)(图18-21)。
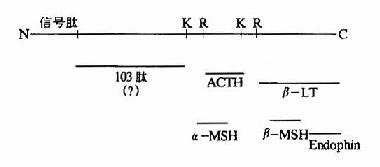
图18-21 POMC作为多种活性物质的前体
第一行为POMC前体,K、R为赖氨酸和精氨酸残基

- 蛋白质翻译后加工修饰《生物化学与分子生物学》
- 蛋白质的元素组成《生物化学与分子生物学》
- 蛋白质分泌细胞《组织学与胚胎学》
- 蛋白质的一级结构《生物化学与分子生物学》
- 蛋白质分子中氨基酸的连接方式《生物化学与分子生物学》
- 蛋白质的吸收《生理学》
- 蛋白质含量测定《中国生物制品规程》
- 蛋白质的四级结构《生物化学与分子生物学》
- 蛋白质合成的抑制剂《生物化学与分子生物学》
- 蛋白质的生物合成《生物化学与分子生物学》
- 蛋白质合成后的分泌及加工修饰《生物化学与分子生物学》
- 蛋白质的生理功用《临床营养学》
- 蛋白质和氨基酸的需要量《临床营养学》
- 蛋白质的生化《临床营养学》
- 蛋白质化学《生物化学与分子生物学》
- 蛋白质的三级结构《生物化学与分子生物学》
- 蛋白质及肽类激素《细胞和分子免疫学》
- 蛋白质的两性电离和等电点《生物化学与分子生物学》
- 蛋白质检查《临床生物化学》
- 蛋白质的理化性质《生物化学与分子生物学》
- 蛋白质能量营养不良《默克家庭诊疗手册》
- 蛋白质的空间结构《生物化学与分子生物学》
- 蛋白质-能量营养不良与贫血《临床营养学》
- 蛋白质的结构与功能的关系《生物化学与分子生物学》
- 蛋白质浓度的测定《动脉粥样硬化》
- 蛋白质的结构及其功能《生物化学与分子生物学》
- 蛋白质-热能营养不良《家庭医学百科-医疗康复篇》
- 蛋白质的胶体性质《生物化学与分子生物学》
- 蛋白质生物合成过程《生物化学与分子生物学》
- 蛋白质的胶体金标记《实用免疫细胞与核酸》
- 蛋白质一级结构的测定方法《生物化学与分子生物学》




