三、电泳分析常用方法
(一)醋酸纤维素薄膜电泳
醋酸纤维素是提纤维素的羟基乙酰化形成的纤维素醋酸酯。由该物质制成的薄膜称为醋酸纤维素薄膜。这种薄膜对蛋白质样品吸附性小,几乎能完全消除纸电泳中出现的“拖尾”现象,又因为膜的亲水性比较小,它所容纳的缓冲液也少,电泳时电流的大部分由样品传导,所以分离速度快,电泳时间短,样品用量少,5μg的蛋白质可得到满意的分离效果。因此特别适合于病理情况下微量异常蛋白的检测。
醋酸纤维素膜经过冰醋酸乙醇溶液或其它透明液处理后可使膜透明化有利于对电泳图谱的光吸收扫描测定和膜的长期保存。
⒈材料与试剂醋酸纤维素膜一般使用市售商品,常用的电泳缓冲液为pH8.6的巴比妥缓冲液,浓度在0.05-0.09mol/L。
⒉操作要点
⑴膜的预处理:必须于电泳前将膜片浸泡于缓冲液,浸透后,取出膜片并用滤纸吸去多余的缓冲液,不可吸得过干。
⑵加样:样品用量依样品浓度、本身性质、染色方法及检测方法等因素决定。对血清蛋白质的常规电泳分析,每cm加样线不超过1μl,相当于60-80μg的蛋白质。
⑶电泳:可在室温下进行。电压为25V/cm,电流为0.4-0.6mA/cm宽。
⑷染色:一般蛋白质染色常使用氨基黑和丽春红,糖蛋白用甲苯胺蓝或过碘酸-Schiff试剂,脂蛋白则用苏丹黑或品红亚硫酸染色。
⑸脱色与透明:对水溶性染料最普遍应用的脱色剂是5%醋酸水溶液。为了长期保存或进行光吸收扫描测定,可浸入冰醋酸:无水乙醇=30:70(V/V)的透明液中。
(二)凝胶电泳
以淀粉胶、琼脂或琼脂糖凝胶、聚丙烯酰胺凝胶等作为支持介质的区带电泳法称为凝胶电泳。其中聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)普遍用于分离蛋白质及较小分子的核酸。琼脂糖凝胶孔径较大,对一般蛋白质不起分子筛作用,但适用于分离同工酶及其亚型,大分子核酸等应用较广,介绍如下:
⒈琼脂糖凝胶电泳的原理概述琼脂糖是由琼脂分离制备的链状多糖。其结构单元是D-半乳糖和3.6-脱水-L-半乳糖。许多琼脂糖链依氢键及其它力的作用使其互相盘绕形成绳状琼脂糖束,构成大网孔型凝胶。因此该凝胶适合于免疫复合物、核酸与核蛋白的分离、鉴定及纯化。在临床生化检验中常用于LDH、CK等同工酶的检测。
⒉琼脂糖凝胶电泳分离核酸的基本技术在一定浓度的琼脂糖凝胶介质中,DNA分子的电泳迁移率与其分子量的常用对数成反比;分子构型也对迁移率有影响,如共价闭环DNA>直线DNA>开环双链DNA。当凝胶浓度太高时,凝胶孔径变小,环状DNA(球形)不能进入胶中,相对迁移率为0,而同等大小的直线DNA(刚性棒状)可以按长轴方向前移,相对迁移率大于0。
⑴设备与试剂:琼脂糖凝胶电泳分为垂直及水平型两种。其中水平型可制备低浓度琼脂糖凝胶,而且制胶与加样都比较方便,故应用比较广泛。核酸分离一般用连续缓冲体系,常用的有TBE(0.08mol/l Tris·HCl,pH8.5,0.08mol/L硼酸,0.0024mol/lEDTA)和THE(0.04mol/l Tris·HCl。pH7.8,0.2mol/L醋酸钠,0.0018mol/lEDTA)。
⑵凝胶制备:用上述缓冲液配制0.5%-0.8%琼脂糖凝胶溶液,沸水浴或微波炉加热使之融化,冷至55℃时加入溴化乙锭(EB)至终浓度为0.5μg/ml,然后将其注入玻璃板或有机玻璃板组装好的模子中,厚度依样品浓度而定。注胶时,梳齿下端距玻璃板0.5-1.0mm,待脱凝固后,取出梳子,加入适量电极缓冲液使板胶浸没在缓冲液下1mm处。
⑶样品制备与加样:溶解于TBE或THE内的样品应含指示染料(0.025%溴酚蓝或桔黄橙)、蔗糖(10%-15%)或甘油(5%-10%),也可使用2.5%Fico Ⅱ增加比重,使样品集中,每齿孔可加样5-10μg。
⑷电泳:一般电压为5-15V/cm。对大分子的分离可用电压5V/cm。电泳过程最好在低温条件下进行。
⑸样品回收:电泳结束后在紫外灯下观察样品的分离情况,对需要的DNA分子或特殊片段可从电泳后的凝胶中以不同的方法进行回收,如电泳洗脱法:在紫外灯下切取含核酸区带的凝胶,将其装入透析袋(内含适量新鲜电泳缓冲液),扎紧透析袋后,平放在水平型电泳槽两电极之间的浅层缓冲液中,100V电泳2-3小时,然后正负电极交换,反向电泳2分钟,使透析袋上的DNA释放出来。吸出含DNA的溶液,进行酚抽提、乙醇沉淀等步骤即可完成样品的回收。
其它还有低融点琼脂糖法、醋酸铵溶液浸出法、冷冻挤压法等,但各种方法都仅仅有利于小分子量DNA片段(<1kb)的回收,随着DNA分子量的增大,回收量显著下降。
(三)等电聚焦电泳技术
等电聚焦(isoelectricfocusing,IEF)是60年代中期问世的一种利用有pH梯度的介质分离等电点不同的蛋白质的电泳技术。由于其分辨率可达0.01pH单位,因此特别适合于分离分子量相近而等电点不同的蛋白质组分。
⒈IEF的基本原理在IEF的电泳中,具有pH梯度的介质其分布是从阳极到阴极,pH值逐渐增大。如前所述,蛋白质分子具有两性解离及等电点的特征,这样在碱性区域蛋白质分子带负电荷向阳极移动,直至某一pH位点时失去电荷而停止移动,此处介质的pH恰好等于聚焦蛋白质分子的等电点(pl)。同理,位于酸性区域的蛋白质分子带正电荷向阴极移动,直到它们的等电点上聚焦为止。可见在该方法中,等电点是蛋白质组分的特性量度,将等电点不同的蛋白质混合物加入有pH梯度的凝胶介质中,在电场内经过一定时间后,各组分将分别聚焦在各自等电点相应的pH位置上,形成分离的蛋白质区带。
⒉pH梯度的组成pH梯度的组成方式有二种,一种是人工pH梯度,由于其不稳定,重复性差,现已不再使用。另一种是天然pH梯度。天然pH梯度的建立是在水平板或电泳管正负极间引入等电点彼此接近的一系列两性电解质的混合物,在正极端吸入酸液,如硫酸、磷酸或醋酸等,在负极端引入碱液,如氢氧化钠、氨水等。电泳开始前两性电解质的混合物pH为一均值,即各段介质中的pH相等,用pH0表示。电泳开始后,混合物中pH最低的分子,带负电荷最多,pI1为其等电点,向正极移动速度最快,当移动到正极附近的酸液界面时,pH突然下降,甚至接近或稍低于PI1,这一分子不再向前移动而停留在此区域内。由于两性电解质具有一定的缓冲能力,使其周围一定的区域内介质的pH保持在它的等电点范围。pH稍高的第二种两性电解质,其等电点为pI2,也移向正极,由于pI2>pI1,因此定位于第一种两性电解质之后,这样,经过一定时间后,具有不同等电点的两性电解质按各自的等电点依次排列,形成了从正极到负极等电点递增,由低到高的线性pH梯度,如图16-3所示。
⒊两性电解质载体与支持介质理想的两性电解质载体应在pI处有足够的缓冲能力及电导,前者保证pH梯度的稳定,后者允许一定的电流通过。不同pI的两性电解质应有相似的电导系数从而使整个体系的电导均匀。两性电解质的分子量要小,易于应用分子筛或透析方法将其与被分离的高分子物质分开,而且不应与被分离物质发生反应或使之变性。
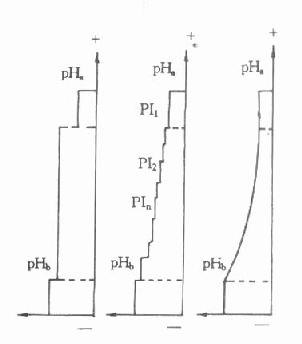
图16-3 pH梯度形成示意图
常用的pH梯度支持介质有聚丙烯酰胺凝胶、琼脂糖凝胶、葡聚糖凝胶等,其中聚丙烯酰胺凝胶为最常应用。
电泳后,不可用染色剂直接染色,因为常用的蛋白质染色剂也能和两性电解质结合,因此应先将凝胶浸泡在5%的三氯醋酸中去除两性电解质,然后再以适当的方法染色。
(四)其他电泳技术
⒈IEF/SDS-PAGE双向电泳法1975年O′Farrall等人根据不同组份之间的等电点差异和分子量差异建立了IEF/Sd S-PAGE双向电泳。其中IEF电泳(管柱状)为第一向,SDS-PAGE为第二向(平板)。在进行第一向IEF电泳时,电泳体系中应加入高浓度尿素、适量非离子型去污剂NP-40。蛋白质样品中除含有这两种物质外还应有二硫苏糖醇以促使蛋白质变性和肽链舒展。
IEF电泳结束后,将圆柱形凝胶在SDS-PAGE所应用的样品处理液(内含SDS、β-巯基乙醇)中振荡平衡,然后包埋在SDS-PAGE的凝胶板上端,即可进行第二向电泳。
IEF/SDS-PAGE双向电泳对蛋白质(包括核糖体蛋白、组蛋白等)的分离是极为精细的,因此特别适合于分离细菌或细胞中复杂的蛋白质组分。
⒉毛细管电泳 Neuhoff等人于1973年建立了毛细管均一浓度和梯度浓度凝胶用来分析微量蛋白质的方法,即微柱胶电泳,均一浓度的凝胶是将毛细管浸入凝胶混合液中,使凝胶充满总体积的2/3左右,然后将其揿入约厚2mm的代用粘土垫上,封闭管底,用一支直径比盛凝胶的毛细管更细的硬质玻璃毛细管吸水铺在凝胶上。聚合后,除去水层并用毛细管加蛋白质溶液(0.1-1.0μl,浓度为1-3mg/ml)于凝胶上,毛细管的空隙用电极缓冲液注满,切除插入粘土部分,即可电泳。
目前毛细管电泳分析仪的诞生,特别是美国生物系统公司的高效电泳色谱仪为DNA片段、蛋白质及多肽等生物大分子的分离、回收提供了快速、有效的途径。高效电泳色谱法是将凝胶电泳解析度和快速液相色谱技术溶为一体,在从凝胶中洗脱样品时,连续的洗脱液流载着分离好的成分,通过一个连机检测器,将结果显示并打印记录。高效电泳色谱法既具有凝胶电泳固有的高分辨率,生物相容性的优点,又可方便地连续洗脱样品。

- 电泳分析常用方法《临床生物化学》
- 电泳分析《实用免疫细胞与核酸》
- 电泳技术的基本原理和分类《临床生物化学》
- 电泳分类法《动脉粥样硬化》
- 电泳技术的应用《临床生物化学》
- 电压门控通道《生理学》
- 电针《中医名词词典》
- 电旋旋旋旋光性眼炎速效二例《三十年临证经验集》
- 电针操作方法《中医刺灸》
- 电旋旋旋旋光性眼炎《中医眼科学》
- 电针的选穴《中医刺灸》
- 电旋旋旋旋光性眼炎《百病自测》
- 电针机《中医词典》
- 电旋光性眼炎的急救《现代院外急救手册》
- 电针疗法《中医刺灸》
- 电兴奋疗法《理疗学》
- 电针疗法《中医词典》
- 电位法测定溶液的PH值《医用化学》
- 电针疗法注意事项《中医刺灸》
- 电睡眠疗法《理疗学》
- 电针麻醉《中医名词词典》
- 电生理学试验《默克家庭诊疗手册》
- 电针麻醉《中医词典》
- 电生理检查《神经病学》
- 电针器的选择《中医刺灸》
- 电热灸《中医词典》
- 电针适应范围《中医刺灸》
- 电气治病《对山医话》
- 电诊断《理疗学》
- 电疗法《康复医学》
- 电子版序《伤寒恒论》




